

Magiczna cecha
Tzw. „stan aromatyczny” jest abstrakcyjnym terminem z chemii kwantowej i
nie ma on nic wspólnego z zapachem związków.
Stan aromatyczny polega na szczególnej delokalizacji elektronów płaskiej
cząsteczki pierścienia zawierającej „magiczną liczbę” elektronów „pi”. Chodzi o
cząsteczki zawierające: 2, 6, 10, 14
itd. zdelokalizowanych elektronów „pi”. Liczby te określone są przez regułę
Hückla: x = 4n+2. Racjonalne
wyjaśnienie znaleźć można w cytowanej literaturze.
Związki aromatyczne mają specyficzne właściwości magnetyczne, optyczne oraz chemiczne. Zwiększenie gęstości elektronowej w pierścieniu powoduje, że substancje te szczególnie łatwo wchodzą w reakcje podstawienia elektrofilowego (np. nitrowania). Tę abstrakcyjną „aromatyczność” można zobaczyć „na własne oczy”.
Kompleksy z TCNE
Proponuję
wykorzystać w tym celu efektowną reakcję tworzenia barwnych kompleksów
Charge-Transfer (CT) pomiędzy szeregiem węglowodorów aromatycznych, a
czterocyjanoetylenem (TCNE).
Powstaniu kompleksu towarzyszy pojawienie się nowego pasma absorpcji. Maksimum absorpcji przesunięte jest tym bardziej w stronę czerwieni (a więc dopełniająca barwa roztworu jest tym bardziej niebieska!), im silniejsze jest oddziaływanie pomiędzy cząsteczkami węglowodoru, a cząsteczką TCNE. Im znaczniejszy jest charakter aromatyczny węglowodoru (większa gęstość elektronowa w pierścieniu), tym silniej barwa kompleksu przesunięta jest w kierunku błękitu. Reakcję wykonuje się w probówce, przez dodanie niewielkiej ilości badanego związku do bezbarwnego 0,1-procentowego roztworu TCNE w suchym chlorku metylenu.
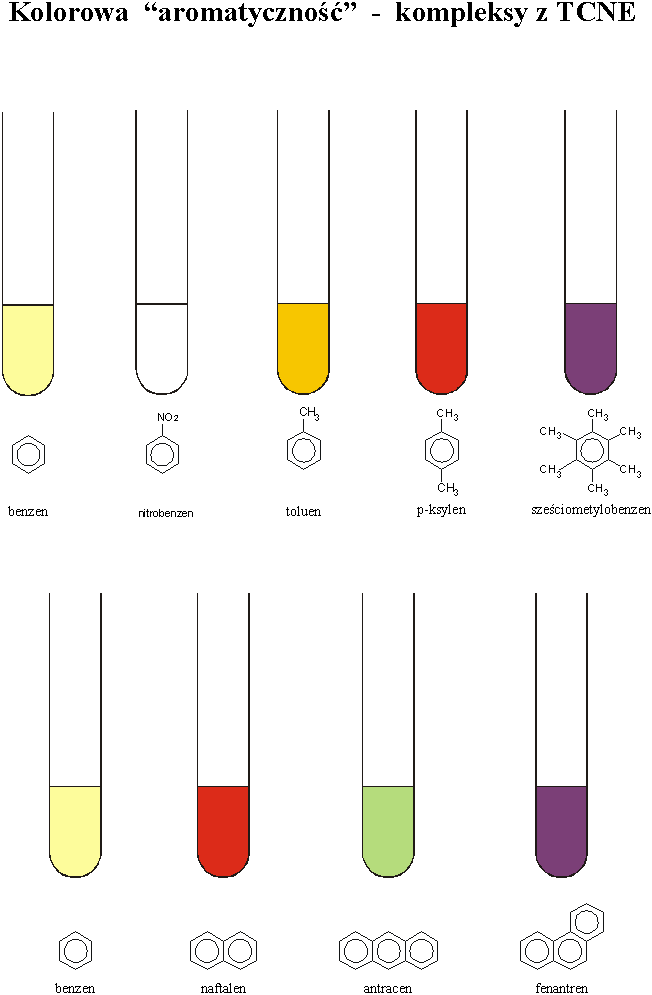
Podstawienie cząsteczki benzenu ugrupowaniami
metylowymi powoduje zwiększenie charakteru
aromatycznego związku, natomiast podstawienie np. grupą nitrową powoduje
odwrotny efekt.
Doświadczalnym potwierdzeniem może być wzrastająca
łatwość reakcji nitrowania w szeregu: benzen – toluen – ksylen. Najsilniej
aromatyczny sześciometylobenzen, powinien jednocześnie najłatwiej ulegać nitrowaniu.
Z drugiej jednak strony, w cząsteczce sześciometylobenzenu brak jest w ogóle
atomów wodoru, które mogłyby ulegać podstawieniu! W rzeczywistości
sześciometylobenzen daje się nitrować w drastycznych warunkach, dając
dwunitropochodną (grupą odchodzącą jest ugrupowanie metylowe, a nie „wodór”).
Skondensowana aromatyczność
Podobne prawidłowości
obserwuje się w szeregu skondensowanych
węglowodorów aromatycznych. Potwierdza się również wyjątkowy charakter
antracenu, który wykazuje nietypową dla węglowodorów aromatycznych skłonność do
reakcji przyłączania. Zielona barwa kompleksu z TCNE szybko zanika na skutek reakcji przyłączenia do pozycji 9,10
antracenu. Produkt tej reakcji ma bardzo słabo zaznaczony charakter aromatyczny. Podobnie słaby charakter aromatyczny ma produkt dimeryzacji antracenu (por.: „fotodimeryzacja antracenu”). Cząsteczka
dimeru nie może być płaska, co uniemożliwia jej osiągnięcie stanu aromatycznego.
W przypadku węglowodorów skondensowanych o większej
liczbie pierścieni, nie trzeba stosować odczynnika tworzącego kompleksy CT.
Ruchliwość elektronów jest tak wielka, że węglowodory takie są barwne. W miarę
powiększania cząsteczki o kolejne pierścienie, barwa przesuwa się w stronę
błękitu, a jednocześnie rośnie jej intensywność. Grafit, będący właściwie
bardzo rozbudowanym układem skondensowanych pierścieni aromatycznych - jest
czarny!
Kwantowy ołówek, kwantowy smar
Czarna
barwa grafitu (i jego zastosowanie do produkcji ołówków) jest więc następstwem
procesów kwantowych. Stwierdzenie to jest mało odkrywcze, bo przecież każda barwa jest wynikiem kwantowych
procesów elektronowych. Jednak doskonałe właściwości smarujące grafitu mogą być
przypisane również procesom kwantowym... Stan
aromatyczny związany jest z płaską budową cząsteczki. Makrocząsteczki
kryształu grafitu tworzą więc równoległe płaszczyzny związane ze sobą jedynie
słabymi oddziaływaniami van der Waalsa. Oddziaływania są tak słabe, że pod
działaniem mechanicznego nacisku następuje „poślizg” warstw kryształu.
Pomimo tak wybitnego charakteru aromatycznego, grafit
oczywiście nie daje się nitrować. Grafit tworzy jednak związki metaliczne np. z
potasem, zdolny jest do tworzenia soli oraz kompleksów CT.
Barwne kompleksy ze związkami aromatycznymi dają również: bezwodnik maleinowy oraz trójnitrofenol. Barwną pochodną najwygodniej jest obserwować po stopieniu i ochłodzeniu mieszaniny. Reakcje te są jednak znacznie mniej atrakcyjne niż reakcje z TCNE.
Okazuje się więc, że charakteru aromatycznego nie da się co prawda wykryć za pomocą nosa, ale można go zobaczyć na własne oczy!
LITERATURA
N.S.Isaacs.
„Fizyczna chemia organiczna. Ćwiczenia”. PWN, Warszawa 1974, ss. 118, 158. [Reakcje z
TCNE]
Z.Jerzmanowska.
„Analiza jakościowa związków organicznych”. PZWL, Warszawa 1967, s. 203.
[„Pikryniany” węglowodorów aromatycznych]
H.A.Staab.
„Wstęp do teoretycznej chemii organicznej”. PWN, Warszawa 1966, s. 75. [Charakter aromatyczny]
R.P.Feynman, R.B.Leighton, M.Sands. „Feynmana wykłady z fizyki. Tom III”. PWN, Warszawa
1972, s. 280. [Stan aromatyczny: liczby „magiczne”]
T.Pluciński. „Doświadczenia
chemiczne”. Wyd. „Adamantan”, Warszawa 1997, s. 96, 181. [Inne barwne kompleksy
CT]
T.Moeller. „Chemia
nieorganiczna dla zaawansowanych”. PWN, Warszawa 1959, s. 594.
P.J.Durrant, B.Durrant. „Zarys współczesnej chemii
nieorganicznej”. PWN, Warszawa 1965, s. 670.
[Grafit i jego związki]
Tomasz Pluciński - tomek@chemik.chem.univ.gda.pl
Praca wpłynęła do ChemFana: 2000-03-29
