

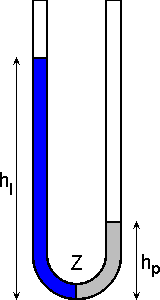
 Jeśli do lewego ramienia pustej U-rurki nalać pewną ilość cieczy, to w najniższym punkcie U-rurki wystąpi parcie cieczy proporcjonalne do iloczynu
ciężaru właściwego ("ro") cieczy i wysokości słupa w lewym ramieniu P =
ro * hl. Parcie jest "siłą napędową" powodującą, że po otworzeniu kranika Z w dolnej części, ciecz będzie się przelewać z lewej do prawej części U-rurki. Wynikiem obniżania się poziomu w lewej części i wzrostu poziomu w prawym ramieniu jest zmniejszanie się różnicy parć cieczy. Zmniejszanie się różnicy parć powoduje, że szybkość przelewania się cieczy z każdą chwilą maleje. W stanie równowagi różnica parć równa jest zero. Teoretycznie, wobec ciągłego zmniejszania się tej "siły napędowej", na ustalenie się stanu równowagi potrzeba nieskończenie długiego czasu. Zamiast operowania pojęciem "czasu reakcji", należy raczej stosować pojęcie "czasu połówkowego reakcji". Nietrudno zauważyć, że szybkość przepływu zależy również od tego jakiej cieczy użyje się do doświadczenia (np. wody czy miodu).
Posługiwanie się
taką analogią hydrauliczną stwarza jednak dydaktyczną pułapkę. Słuchacze
mają pokusę aby uznać, że stan równowagi istnieje tylko
wtedy, gdy poziomy cieczy w obu ramionach są
równe. I analogicznie, błędnie
wnioskują że stan równowagi
chemicznej jest to stan, gdy stężenia substratów i produktów są sobie równe (czyli tylko wtedy gdy wydajności równe są 50%).
Jeśli do lewego ramienia pustej U-rurki nalać pewną ilość cieczy, to w najniższym punkcie U-rurki wystąpi parcie cieczy proporcjonalne do iloczynu
ciężaru właściwego ("ro") cieczy i wysokości słupa w lewym ramieniu P =
ro * hl. Parcie jest "siłą napędową" powodującą, że po otworzeniu kranika Z w dolnej części, ciecz będzie się przelewać z lewej do prawej części U-rurki. Wynikiem obniżania się poziomu w lewej części i wzrostu poziomu w prawym ramieniu jest zmniejszanie się różnicy parć cieczy. Zmniejszanie się różnicy parć powoduje, że szybkość przelewania się cieczy z każdą chwilą maleje. W stanie równowagi różnica parć równa jest zero. Teoretycznie, wobec ciągłego zmniejszania się tej "siły napędowej", na ustalenie się stanu równowagi potrzeba nieskończenie długiego czasu. Zamiast operowania pojęciem "czasu reakcji", należy raczej stosować pojęcie "czasu połówkowego reakcji". Nietrudno zauważyć, że szybkość przepływu zależy również od tego jakiej cieczy użyje się do doświadczenia (np. wody czy miodu).
Posługiwanie się
taką analogią hydrauliczną stwarza jednak dydaktyczną pułapkę. Słuchacze
mają pokusę aby uznać, że stan równowagi istnieje tylko
wtedy, gdy poziomy cieczy w obu ramionach są
równe. I analogicznie, błędnie
wnioskują że stan równowagi
chemicznej jest to stan, gdy stężenia substratów i produktów są sobie równe (czyli tylko wtedy gdy wydajności równe są 50%).
jest wielkością stałą i jest jednocześnie liczbową miarą (odwrotności) stosunku ciężarów właściwych tych cieczy.
Ze stałości stosunku wysokości słupów cieczy wynika możliwość przewidywania następstw zakłócenia stanu równowagi hydraulicznej w U-rurce. Jeśli do lewego ramienia dolać pewną ilość wody (np. dodatkową warstwę o wysokości 2 cm), to układ taki nie będzie się już znajdował w stanie równowagi (2:24 < 0,0909). Zwiększone parcie w lewym ramieniu spowoduje przelanie się pewnej ilości wody (odpowiadającej wysokości x) do prawego ramienia, aż do wytworzenia po pewnym czasie nowego stanu równowagi, w którym będą co prawda istniały nowe, inne niż przedtem wysokości słupów cieczy, lecz wysokości te będą spełniały warunek:
W identyczny sposób można przewidzieć zmiany powstałe np. przez usunięcie strzykawką pewnej ilości cieczy z prawego ramienia, i wyliczenie w oparciu o stałą wartość liczbową współczynnika "k", nowych wartości poziomów równowagi cieczy. A teraz chemia...
Jeśli w zlewce umieścić roztwór mieszaniny substratów o pewnych stężeniach początkowych, to w roztworze zacznie zachodzić reakcja chemiczna: substraty --> produkty. Przyczyną zachodzenia reakcji jest potencjał chemiczny substratów, zależny od rodzaju użytych substancji, a proporcjonalny do ich stężenia (często: do iloczynu ich stężeń). Szybkość reakcji od tego momentu stale maleje, gdyż w wyniku zużywania substratów maleje ich stężenie, a więc również i ich potencjał chemiczny. Dodatkowo, z każdą chwilą rośnie stężenie produktów reakcji, a wraz z tym ich potencjał chemiczny. Ostatecznie, z każdą chwilą wzrasta szybkość reakcji odwrotnej: produkty --> substraty. Po dostatecznie długim czasie wytwarza się stan równowagi dynamicznej, w którym potencjały chemiczne substratów i produktów są sobie równe; zrównują się również szybkości reakcji "w prawo" i "w lewo". W stanie tym stężenia substratów i produktów nie są najczęściej identyczne, lecz spełniają warunek:
(nawiasy kwadratowe oznaczają stężenia odpowiednich substancji w stanie równowagi). Wartość liczbowa stałej równowagi "K" jest proporcjonalna do standardowego potencjału chemicznego substratów i jest odwrotnie proporcjonalna do standardowego potencjału chemicznego produktów. Jest więc ona również miarą
"skłonności" układu chemicznego do reagowania "w prawo".
W chemii mamy często do czynienia z stanami równowagi opisywanymi przez stałą np. K = 10-20. Gdyby chcieć odwołać się do analogii z U-rurką, to dla zrównoważenia słupa cieczy o wysokości 1 cm, w drugim ramieniu powinna być ciecz o wysokości (hipotetycznie) sięgającej daleko poza nasz układ planetarny!
Jeśli do układu znajdującego się w stanie równowagi dodać pewną ilość substratów, to stan równowagi zostanie zakłócony. W wyniku wzrostu potencjału chemicznego substratów zwiększy się szybkość procesu "w prawo". Część dodanego nadmiaru substratów przereaguje tworząc pewną dodatkową ilość produktów. Doprowadzi to do wytworzenia nowego stanu równowagi, w którym co prawda będą współistniały inne stężenia reagentów, lecz te nowe stężenia będą ciągle spełniały poprzednią zależność liczbową: [produkty] : [substraty] = constans. Stałość tak sformułowanego ułamka pozwala więc zarówno na jakościowe przewidzenie kierunku zmian po podziałaniu czynnika zakłócającego stan równowagi chemicznej
(stąd wynika zasada przekory Le Chatelier a-Browna), jak i na obliczenie nowych wartości stężeń wszystkich substancji, po wytworzeniu nowego stanu równowagi. Taki jest realny pożytek ze stosowania prawa równowagi chemicznej (prawa działania mas)...
Tomasz Pluciński - tomek@chemik.chem.univ.gda.pl
Praca wpłynęła do Chemfana: 18-06-1999
