

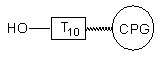
Zgodnie z tymi założeniami, oligomer I
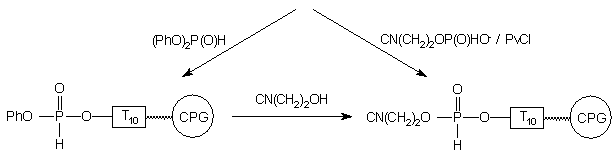
traktowałem H-fosfonianem 2-cyjanoetylowym (10min., 0,2 M; 40 ml; Py-CH3CN
1:1) w obecności PivCl jako czynnika kondensującego (0,3 M; 80 m l; Py-CH3CN
1:1 v/v) (Schemat 42).
Analiza (PAGE) surowej mieszaniny poreakcyjnej (po
usunięciu grup ochronnych) wykazała obecność praktycznie jednego produktu,
5'-H-fosfonianu oligomeru (II). Taki wynik wskazuje, że reakcja
fosfonylacji w powyższych warunkach zachodzi ilościowo, a otrzymany 5'-(2-cyjanoetylo)-H-fosfonian
oligonukleotydu może być stosowany do dalszych etapów funkcjonalizacji
oligomeru związanego z podłożem.
I
|
|
|
Schemat 42
Dodatkową, ważną informacją wynikającą z tego doświadczenia jest to, że otrzymany nową metodą (str. *), krystaliczny H-fosfonian 2-cyjanoetylowy, może być z powodzeniem stosowany jako efektywny i syntetycznie użyteczny czynnik fosfonylujący.
Obydwie opisane powyżej metody syntezy 5'-(2-cyjanoetylo)-H-fosfonianów oligonukleotydów typu VIII okazały się równie skuteczne. Metoda bezpośredniej fosfonylacji aktywowanym (PivCl) H-fosfonianem 2-cyjanoetylowym jest szybsza i nie wymaga zmiany oprogramowania jednostki sterującej pracą syntetyzera. Natomiast podejście z użyciem fosforynu difenylowego, nie angażujące chlorku piwaloilu jako czynnika kondensującego, można polecać w przypadkach gdy oligonukleotyd zawiera modyfikowane jednostki nukleotydowe podatne na acylowanie.
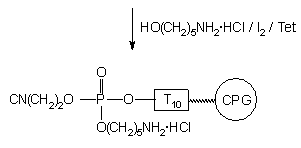
Kondensacja oksydatywna
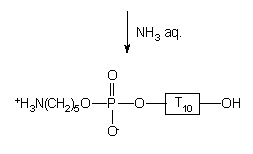
W celu wprowadzenia funkcji aminoalkilowej, oligomer typu VIII poddany został działaniu (10 min.) pirydynowego roztworu utleniającego zawierającego: jod (3%), chlorowodorek aminopentanolu (0,2M) i tetrazol (0,5M). Zgodnie z wynikami doświadczeń na związkach modelowych (str. *), protonowany aminoalkohol powinien przyłączać się chemoselektywnie tworząc fosforotriester. Analiza produktów reakcji po ich odblokowaniu (PAGE, Zdjęcie 4) wykazała obok pożądanego produktu kondensacji (sfunkcjonalizowanego oligonukleotydu VI), obecność znacznej ilości (~ 50%) 5'-fosforanu oligonukleotydu, powstałego, być może, wskutek obecności wody, której zawartości w medium utleniającym nie udało się uniknąć.
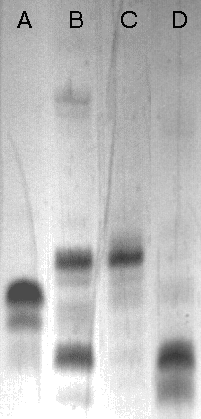
| linia A: T10 (I)
linia B: analizowana mieszanina linia C: 5'-aminopentylo-T10 (VI) linia D: 5'-H-fosfonian-T10 (II) |
Zdjęcie 4
Kilkakrotne powtarzanie reakcji, w których możliwie starannie przygotowano substraty, prowadziło do bardzo podobnych rezultatów. Można więc przypuszczać, że obok cząsteczek wody, także niedostateczny udział tetrazolu w procesie utleniania może wpływać na powstawanie innych produktów utleniania niż spodziewane fosforotriestry. Chodzi o to, że w reakcjach oksydatywnej kondensacji prowadzonych w roztworze, tetrazol skutecznie ukierunkowywał te reakcje na powstawanie fosforotriestrów (str. *). Jest prawdopodobne, że w układzie heterogennym tworzenie domniemanych, przejściowych fosforotetrazolidów jest znacznie utrudnione. W konsekwencji, z utworzonego na pierwszym etapie utleniania jodofosforanu powstają także inne pochodne (np. pirydyniowy addukt fosforodiestru i produkty jego dealkilacji), które uniemożliwiają tworzenie pożądanych fosforotriestrów. Mając na uwadze powtarzalność wyników kilkakrotnie wykonanych reakcji oksydatywnych kondensacji, sądzę, że niedostateczna efektywność działania tetrazolu jako katalizatora nukleofilowego, w powyższych reakcjach prowadzonych w układzie heterogennym, mogła mieć znaczący (o ile nie decydujący) wpływ na charakter i stosunek ilościowy otrzymanych produktów (fosforodi- i monoestry vs fosforotriestry).
Podsumowując, próby funkcjonalizacji 5'-(2-cyjanoetylo)-H-fosfonianów oligonukleotydów związanych z podłożem stałym na drodze oksydatywnej kondensacji z aminoalkoholem zakończyły się połowicznym sukcesem. W przeciwieństwie do oksydatywnej kondesacji przebiegającej w roztworze, w układzie heterogennym reakcje te prowadziły do prawie równomolowych ilości di- i triestrów fosforanowych. Tak więc, na obecnym etapie zaawansowania prac nie mogę polecać tego podejścia jako wydajnej metody syntezy oligonukleotydów sfunkcjonalizowanych grupami aminoalkilowymi.
