

 |
 |
 |
||
|
|
|
|||
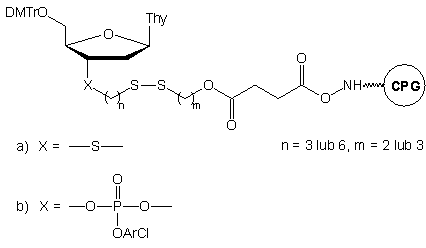
W przedstawionym powyżej podejściu pierwsza jednostka nukleozydowa jest
już związana z podłożem. Implikuje to konieczność posiadania zestawu czterech
tego typu podłoży (A, C, G, T), aby możliwa była synteza oligomerów niezależnie
od rodzaju nukleotydu na ich 3'-końcu. Dla uniknięcia tej niedogodności
zaproponowano bardziej uniwersalne podłoże typu 3.24
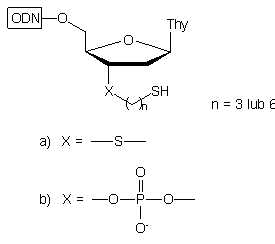
Nie zawiera ono reszty nukleozydowej, może więc być użyte do syntezy modyfikowanych
oligonukleotydów o dowolnej sekwencji. Po syntezie, do odblokowania oligomerów
i jednoczesnej redukcji wiązań disiarczkowych stosowano roztwór DTT w wodnym
amoniaku.
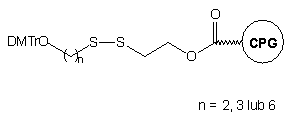 |
 |
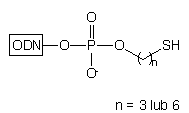 |
|
|
|
W przypadku gdy n = 2, w rezultacie wewnątrzcząsteczkowej eliminacji siarczku etylenu, nie otrzymywano 3'-tiolo-oligonukleotydu, lecz oligonukleotyd 3'-fosforylowany typu 5:
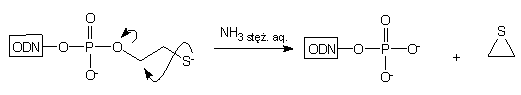
|
|
5
|
6
|
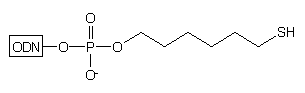
W innym podejściu25 prowadzącym do oligomeru typu 4
(n=6), wychodzi się ze specjalnie przygotowanego podłoża stałego,26
zawierającego wolne grupy tiolowe zamiast aminowych. Podłoże to aktywowano
2,2'-ditio-bis(5-nitropirydyną) i poddawano reakcji z 4,4'-dimetoksytrytyloksy-6-merkaptoheksanem24
uzyskując podłoże 7. Oligomery typu 4 otrzymywano
na tym podłożu wg typowej procedury syntezy i odblokowania:
 |
 |
 |
|
|
|
W kolejnym podejściu zaproponowano27,28 wykorzystanie podłoża
8,
z łącznikiem otrzymanym w oparciu o [2-(2-chloroetoksy)etoksy]etanol. Łańcuch
łącznika zawierający mostki tlenowe jest podatny na hydratację, w środowisku
wodnym nie powinien więc mieć tendencji do tworzenia skłębionej struktury,
spodziewanej w takich warunkach dla łańcucha węglowodorowego. Można więc
oczekiwać, że przy zastosowaniu takiego łącznika grupa reporterowa nie
powinna być uwikłana w oddziaływania trzeciorzędowe z oligonukleotydem,
będąc jednocześnie dobrze eksponowana dla np. przeciwciał. Modyfikowane
oligonukleotydy typu 9 otrzymywano w sposób analogiczny do
opisanego powyżej dla podłoża typu 3.
 |
 |
 |
|
|
|
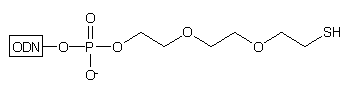
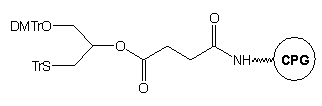
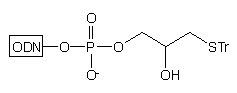
Zastosowanie podłoża typu 10 w syntezie oligonukleotydów
pozwala na otrzymywanie, po odblokowaniu stężonym NH3 aq., oligomerów
typu 11, z resztą tiolową chronioną grupą trytylową:29
 |
 |
 |
|
|
|
Obecność lipofilowej grupy trytylowej w cząsteczce ułatwia oczyszczenie otrzymanego oligonukleotydu za pomocą RP-HPLC*. Usunięcie grupy trytylowej następuje w wyniku działania AgNO3/DTT. Na końcu 3' oligomeru typu 11 oprócz reszty tiolowej obecna jest reszta hydroksylowa. W obecnie stosowanych podejściach nie znajduje ona zastosowania, może być jednak wykorzystana jako potencjalne miejsce przyłączania dodatkowego ugrupowania czynnego spektralnie, enzymatycznie lub immunologicznie.
Należy zauważyć, że praca z oligonukleotydami niosącymi wolną resztę tiolową wymaga szczególnej uwagi. Bardzo łatwo następuje bowiem utlenienie tej grupy tlenem z powietrza z wytworzeniem mostka disiarczkowego, co uniemożliwia przyłączenie grupy reporterowej. Konieczna jest zatem praca w warunkach beztlenowych lub prowadzenie reakcji wobec nadmiaru substancji redukującej (np. DTT), co wiąże się z kolei z koniecznością dodatkowego oczyszczania gotowej sondy oligonukleotydowej. Natomiast stosowanie jonów srebra lub rtęci do usuwania ochronnej grupy trytylowej wiąże się z niebezpieczeństwem zanieczyszczenia nimi sondy, co może być przyczyną degradacji badanych kwasów nukleinowych.
 |
 |
 |
|
|
|
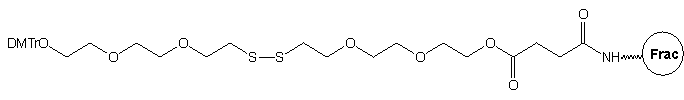
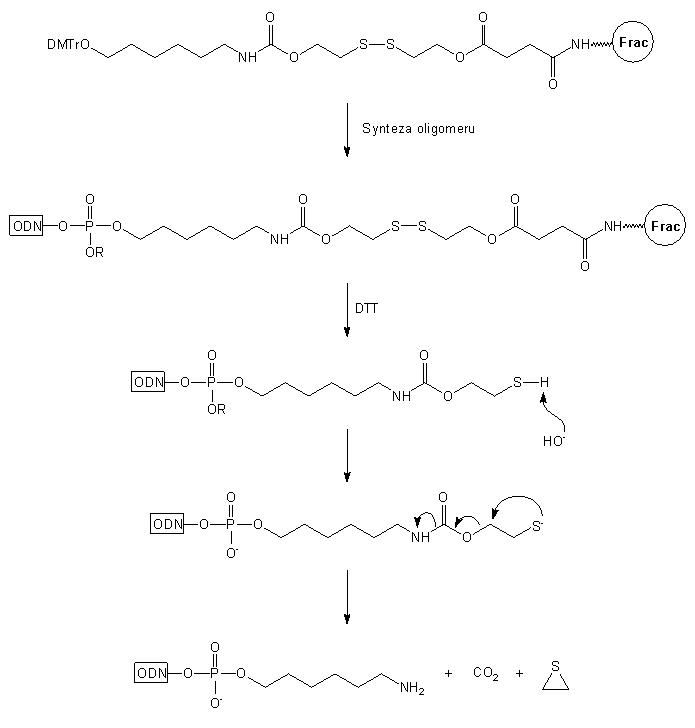
Innym podłożem pozwalającym uzyskiwać modyfikowane oligomery typu 13
jest podłoże 1427 (Schemat 1). Jego główne elementy
strukturalne to dimetoksytrytylowana grupa hydroksylowa, ugrupowanie karbamidoestrowe
i mostek disiarczkowy. Po syntezie oligonukleotydu na tym podłożu, końcowe
odblokowanie przeprowadza się wodnym roztworem NH3 stęż./DTT.
Uwolnienie reszty aminowej w trakcie odblokowania autorzy tłumaczą reakcjami
przedstawionymi na Schemacie 1. Pod wpływem DTT następuje redukcja mostka
disiarczkowego, a powstałe ugrupowanie tiolowe w środowisku zasadowym ulega
reakcji wewnątrzcząsteczkowej eliminacji, a następnie dekarboksylacji,
co prowadzi do oligomeru typu 13 z grupą aminoalkilową na
końcu 3'.
 |
14 |
|||
|
|
||||
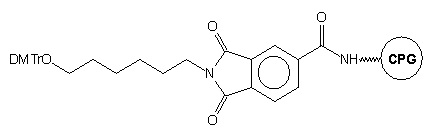
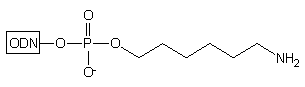
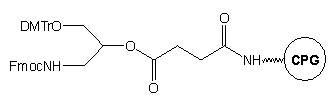
Przyłączenie N-Fmoc-O1-DMTr-3-amino-1,2-propanodiolu*
do standardowego podłoża szklanego LCAA-CPG pozwala na otrzymanie modyfikowanego
podłoża typu 15, w którym reszta hydroksylowa blokowana jest
grupą dimetoksytrytylową (DMTr), a aminowa - grupą fluoren-9-ylometoksykarbonylową
(Fmoc).31 Grupą funkcyjną podczas syntezy oligonukleotydu jest
grupa hydroksylowa. Ostatni etap syntezy oligonukleotydu tj. odblokowanie
stężonym roztworem amoniaku, powoduje odblokowanie także reszty aminowej,
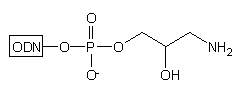
prowadząc do oligomeru typu 16. Podobnie jak oligonukleotyd
typu 11, posiada on na 3'-końcu dwie grupy funkcyjne: aminową
i hydroksylową, potencjalnie użyteczne do przyłączania różnego typu grup
reporterowych.
 |
 |
 |
||
|
|
|
|||
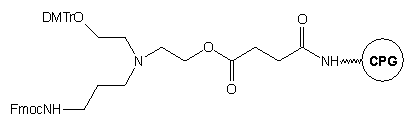
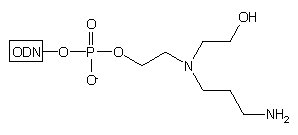
Innym przykładem podłoża prowadzącego do oligomeru z dwiema grupami funkcyjnymi (hydroksylową i aminową), jest podłoże 17.32 Podobnie jak w przypadku podłoża typu 15, grupą funkcyjną podczas syntezy oligomeru jest grupa hydroksylowa. Końcowe odblokowanie po syntezie oligonukleotydu na podłożu 17 można przeprowadzać w łagodniejszym od roztworu amoniaku środowisku reakcji: Py/AcOH/NH2NH2.H2O - 24h, temp. pok.* 50% etylenodiamina (EDA) w EtOH - 6h, temp. pok.
Takie warunki odblokowania pozwalają na syntezę 3'-sfunkcjonalizowanych
metylofosfonianów oligonukleotydów (odpornych na działanie nukleaz analogów
oligonukleotydów), gdyż diestry metylofosfonianowe są nietrwałe w wodnym
stężonym roztworze amoniaku. Warunkiem koniecznym powodzenia takiej syntezy
jest zastosowanie reszty fosforodiestrowej na 3'-końcu oligomeru.
 |
|
 |
|
|
|
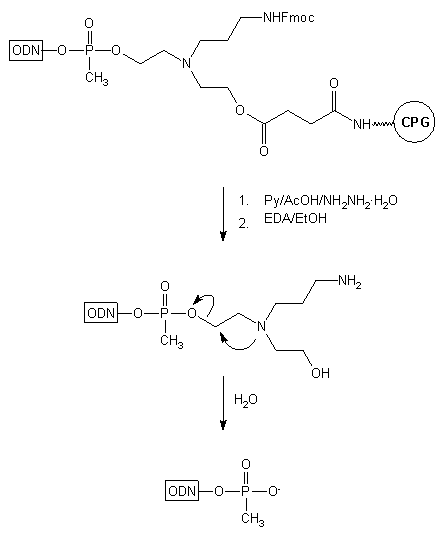
W przypadku wprowadzenia metylofosfonianu jako pierwszej jednostki nukleotydowej
na końcu 3' (oligomer typu 19, Schemat 2) grupa N-(2-hydroksyetylo)-N-(3-aminopropylo)-2-aminoetylowa
ulega eliminacji. Tłumaczone jest to atakiem trzeciorzędowego atomu azotu
łącznika na atom węgla związany z grupą metylofosfonianową (oligomer typu
20),
z wytworzeniem pochodnej azyrydynowej i eliminacją metylofosfonianu (21).
Natomiast wprowadzenie w tej tylko, 3'-końcowej pozycji, standardowej reszty
fosforanowej, pozwalało na otrzymanie oligonukleotydu typu 18,
trwałego w warunkach odblokowania.
 |
19
20
21 |
Schemat 2
W kolejnym podejściu zaproponowano wprowadzenie na końcu 3' oligonukleotydu wielu grup reporterowych,33-35 zakładając, że tego typu modyfikacja pozwoli na uzyskanie znacznego wzrostu czułości sondy. W tym celu zsyntetyzowano podłoża typu 22, wykorzystując strategię stosowaną przy otrzymywaniu oligopeptydów. W łańcuchu peptydowym podłoża występowały reszty lizyny (ich łańcuchy boczne z pierwszorzędowymi resztami aminowymi to potencjalne miejsca przyłączenia grup reporterowych) poprzedzielane cząsteczkami alaniny i/lub kwasu 6-aminoheksanowego (jako cząsteczkami oddala-ją-cymi od siebie aktywne reszty lizynowe - "spacer"). Na tak zmodyfikowanym podłożu przeprowadzono następnie standardową syntezę oligonukleotydu połączonego z oligopeptydem od 3'-końca. Grupy reporterowe można przyłączać do podłoża w różnych fazach otrzymywania sondy: (i) w trakcie syntezy oligopeptydu w postaci zmodyfikowanych syntonów lizynowych,33 (ii) po zakończeniu syntezy oligopeptydu, a przed rozpoczęciem syntezy oligonukleotydu,34 bądź (iii) po zakończeniu syntezy, przed odcięciem oligomeru od podłoża.34,35
Stwierdzono, że wprowadzenie wielu cząsteczek fluoresceiny spowodowało efekt odwrotny od oczekiwanego: nastąpiło silne wygaszenie fluorescencji, będące prawdo-podobnie wynikiem niepromienistego przeniesienia energii pomiędzy sąsiednimi cząsteczkami fluoroforu.34 Natomiast wielokrotne znakowanie biotyną powoduje znaczące zwiększenie czułości sondy (pięciokrotne przy dziesięciu cząsteczkach biotyny).34,35
Wprowadzanie grupy aldehydowej
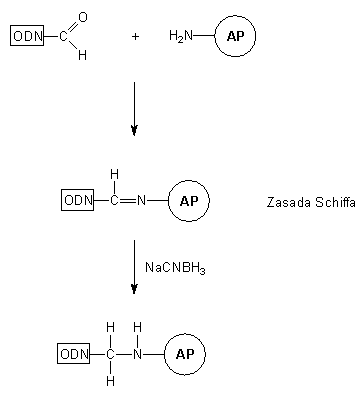
Schemat 3
Modyfikowane oligonukleotydy niosące reszty aldehydowe wykorzystywane są do przyłączania oligopeptydów lub białek, np. enzymów takich jak alkaliczna fosfataza lub peroksydaza z chrzanu. Grupa aldehydowa zmodyfikowanego oligomeru reaguje z resztami aminowymi białka (N-koniec łańcucha peptydowego, reszty aminowe lizyny i argininy) tworząc iminę (typu zasady Shiffa). Redukcja (cyjanoborowodorek sodu) ugrupowania iminowego prowadzi do oligonukleotydu związanego z białkiem trwałym wiązaniem alkiloaminowym (Schemat 3).
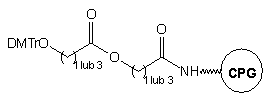
23
Przykładem podłoża wprowadzającego resztę aldehydową do oligomeru jest
podłoże 23.36 Szkielet łącznika zbudowany jest
z reszt aminokwasów połączonych wiązaniami peptydowymi (kwas 6-aminoheksanowy,
lizyna i alanina). Chroniona kwasowo-labilną grupą piksylową reszta hydroksylowa
(służąca do syntezy oligomeru) przyłączona jest do ostatniej reszty aminowej
łącznika w cząsteczce kwasu 4-hydroksybutanowego. Boczny łańcuch lizyny
służy do przyłączenia reszty kwasu p-aldehydobenzoesowego niosącego
wolną grupę aldehydową, nieaktywną podczas syntezy łańcucha oligonukleotydowego.
Po syntezie oligonukleotydu i odblokowaniu (0,1 M NaOH)37 uzyskano
oligomer z wolną grupą aldehydową, wykorzystaną do przyłączenia alkalicznej
fosfatazy.
Łączniki wprowadzające różne grupy funkcyjne
Na szczególną uwagę zasługują podejścia, w których wychodząc z jednego
uniwersalnego podłoża możliwe jest uzyskanie oligomerów niosących różne
grupy funkcyjne.
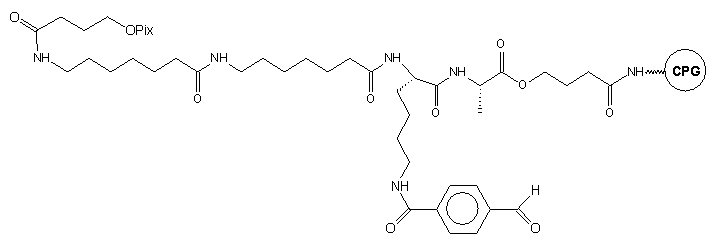 |
|
|
Przykładem realizacji takiej koncepcji jest podłoże typu 24.38-40 Po syntezie oligonukleotydu na takim podłożu, stosując różne sposoby odblokowania uzyskano oligomery niosące różne grupy funkcyjne na końcu 3' (Tabela 2).
Tabela 2
| Warunki odblokowania | Produkt |
| 1. NH3 stęż./H2O |
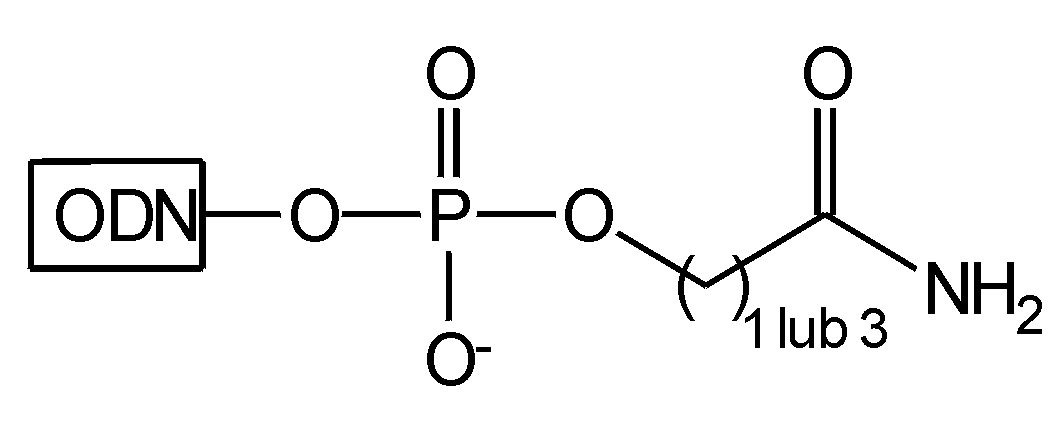
25 |
| 1. N2H4/AcOH/Py*
2. H2N(CH2)2-4NH2 |
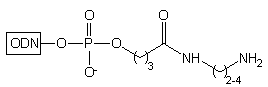
|
| 1. N2H4/AcOH/Py*
2. H2N(CH2)2SS(CH2)2NH2 3. DTT/H2O |
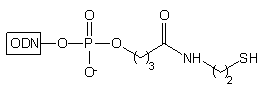
|
| 1. OH-
2. NH3 stęż./H2O |
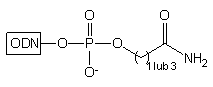
|
Zastosowanie typowej procedury odblokowującej (roztwór amoniaku) powoduje amonolizę wiązania estrowego, prowadząc do powstania reszty amidowej (związek typu 25).

Jeżeli w miejsce amoniaku stosuje się alkilodiaminę, wówczas wg tego
samego mechanizmu otrzymuje się oligomer typu 26, z grupą
aminoalkilową na końcu 3'. Wg powyższego schematu, zastosowanie alkilodiamin
z wewnętrznymi mostkami disiarczkowymi w pierwszym etapie odblokowania
prowadzi do produktów aminolizy. Dodanie do mieszaniny reakcyjnej ditiotreitolu
(DTT) redukuje wiązania disiarczkowe, dając w efekcie oligomery typu 27
niosące na końcu 3' wolne grupy tiolowe. Prowadzenie pierwszego etapu odblokowania
w warunkach hydrolitycznych powoduje uwolnienie do roztworu oligomerów
typu 28 z resztą karboksylową na 3'-końcu.
Łączniki wprowadzające grupę reporterową
Chcąc uniknąć nie zawsze dostatecznie wydajnego etapu przyłączania grupy reporterowej w roztworze zaproponowano podłoża z już przyłączonym znacznikiem i jednocześnie umożliwiające syntezę oligonukleotydu.
Przykładem takiego podejścia jest podłoże typu 29,41 do którego przez bifunkcyjny łącznik dowiązano fluoresceinę chronioną grupami piwaloilowymi, zsynchronizowanymi w trakcie syntezy i odblokowania z innymi grupami ochronnymi oligonukleotydu. Po syntezie łańcucha oligomeru wg standardowych procedur, a następnie odblokowaniu (NH3 aq. stęż.) uzyskano produkt końcowy 30 - oligonukleotyd z przyłączoną na 3'-końcu fluoresceiną.
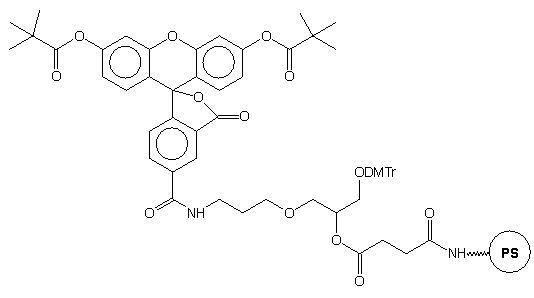 |
29 |
 |
|
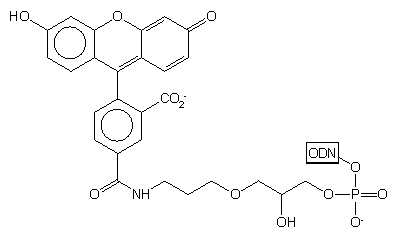 |
30 |
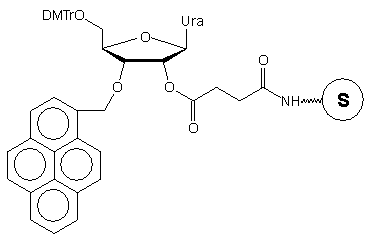
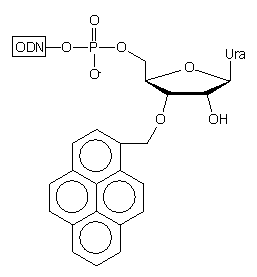
W podłożu typu 31 jako łącznik wykorzystano trójfunkcyjną
resztę cukrową urydyny.42 Funkcja 2'-hydroksylowa posłużyła
do połączenia reszty rybozy z podłożem, znacznik fluorescencyjny - piren
przyłączono w pozycji 3', a funkcję 5'-hydroksylową (zablokowaną grupą
dimetoksytrytylową) wykorzystano do syntezy łańcucha oligonukleotydowego.
Po odblokowaniu (NH3 aq. stęż.) uzyskuje się oligomery typu
32,
w których ostatnim nukleozydem z końca 3' jest 3'-O-(1-pirenylometylo)urydyna.
 |
 |
 |
|
|
|
Łączniki dające trwałe przyłączenie oligomeru do podłoża
W większości stosowanych procedur wykrywania poszukiwanych sekwencji, mieszanina DNA (lub RNA) jest immobilizowana na membranach (nitroceluloza, modyfikowane nylony) i następnie poddawana analizie sondą molekularną, aplikowaną w roztworze. Stosuje się także inne podejścia, w których sonda oligonukleotydowa jest trwale przyłączona do podłoża stałego i następnie traktowana mieszaniną kwasów nukleinowych. Utworzony hybryd, DNA (RNA) - sonda molekularna, jest także (poprzez sondę) związany z podłożem i w tej formie jest wykrywany. To podejście jest szczególnie wygodne wtedy, gdy analizowany DNA (RNA) jest znakowany radioizotopem. W przypadku obecności poszukiwanej sekwencji w analizowanym materiale, powstały dupleks jest także radioaktywny, co można stwierdzić za pomocą prostych detektorów promieniowania.
 |
|
|
Innym wariantem tego typu podejścia może być zastosowanie tak zmodyfikowanego
podłoża stałego, aby po syntezie DNA i jego odblokowaniu (NH3 aq.
stęż.), oligomer pozostał trwale związany z podłożem. Pozwala to
na ominięcie dwóch etapów procedury: odcięcia oligonukleotydu od podłoża
i jego ponownego immobilizowania. Zaproponowano więc podłoża stałe typu
33,
w których zastosowano łączniki posiadające na końcu łańcucha resztę hydroksylową.43,44
Podczas syntezy oligonukleotydy połączone były z podłożem wiązaniem triestrowym
z grupą 2-cyjanoetylową, analogicznym do wiązania internukleotydowego.
W praktyce, w warunkach odblokowania (30-35% NH3 aq. / 55°/
10h) znaczna część oligomeru (40 - 90%) ulega jednak odcięciu od podłoża,
co znacznie ogranicza stosowalność metody.
Podsumowanie
Z przedstawionych metod funkcjonalizacji końca 3' oligomerów za najciekawsze uważam podejście umożliwiające uzyskiwanie różnych grup funkcyjnych w zależności od warunków odblokowania (Tabela 2). Jest to metoda w miarę uniwersalna, pozwalająca na uzyskiwanie różnych grup funkcyjnych, co stwarza potencjalne możliwości dalszych różnego typu modyfikacji. Na uwagę zasługują również podejścia, w których synteza sond oligonukleotydowych odbywa się na podłożach z wcześniej dowiązanymi grupami reporterowymi (Podrozdział C). Po syntezie, podczas odblokowania, oligomer jest uwalniany z podłoża wraz z przyłączoną na jego końcu 3' grupą reporterową. W tym podejściu grupa reporterowa musi być trwała w trakcie syntezy i odblokowania oligomeru, co znacznie ogranicza liczbę możliwych do wykorzystania znaczników.
Niewątpliwym mankamentem wszystkich opisywanych metod jest fakt, że reakcje modyfikacji podłoża zachodzą w układzie heterogennym, co w większości przypadków uniemożliwia bezpośrednią analitykę produktów poszczególnych etapów modyfikacji. Mając na uwadze powyższe oraz bardzo dużą pracochłonność procedur, szersze zastosowanie opisanych metod na tym etapie ich rozwoju wydaje się być wątpliwe.
