

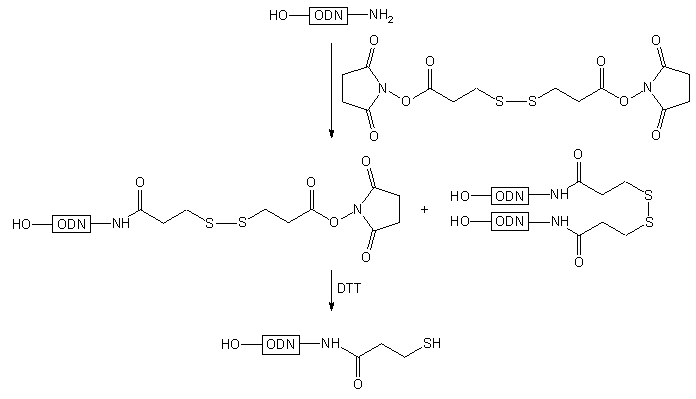
Przykładem takiego rozwiązania może być podejście94, w którym
oligomer z wolną grupą -NH2 na końcu 3' acylowano handlowym
bifunkcyjnym estrem N-hydroksybursztynimidowym kwasu ditio-bis-propionowego
(112) i po redukcji (DTT) ugrupowania disiarczkowego otrzymywano
produkt finalny 113 z wolną grupą -SH.
 |
112 |
|
|
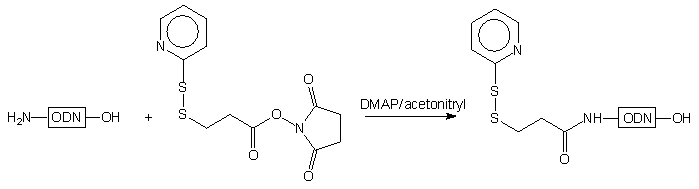
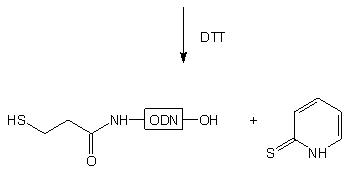
W podobnej metodzie59 zastosowano monofunkcyjny reagent,
3-(2-pirydyloditio)propionian N-hydroksybursztynimidu 114.
Także w tym przypadku wolne reszty -SH, tym razem na końcu 5', oligomeru
115
generowano po redukcji disiarczku ditiotreitolem.
 |
|
|
 |
|
|
Innym, prostszym podejściem26 wydaje się być takie, w którym zastosowano tiolakton N-acetylo-dl-homocysteiny (116), gdyż acylowanie grupy -NH2 zachodzi z otwarciem pierścienia tiolaktonu i wygenerowaniem wolnej reszty -SH.
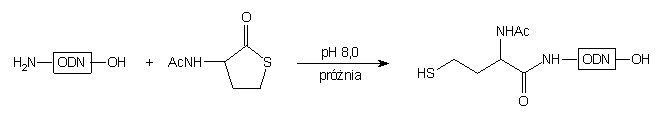 |
| 116 |
Do zamiany grup funkcyjnych stosowano także118 reagenty acylujące,
w których funkcja -SH chroniona jest grupą acetylową (117).
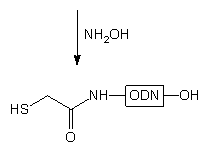
Na drugim etapie usuwano grupę blokującą (hydroksyloamina) otrzymując sfunkcjonalizowany
5'-SH oligonukleotyd typu 118.
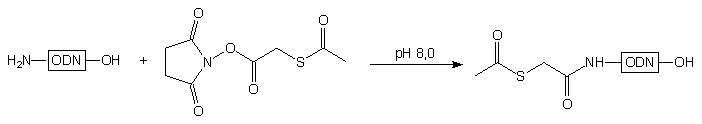 |
|
|
 |
|
118
|
Otrzymywanie oligomerów z wolnymi grupami tiolowymi wiąże się zawsze
z pewnymi komplikacjami wynikającymi z łatwości utlenienia tych ugrupowań.
Konieczne jest zapewnienie w środowisku reakcji warunków beztlenowych (próżnia,
atmosfera obojętna, dodatek reduktorów do reakcji). Utrudnienie to w przypadku
grup aminowych nie występuje.
