

 |
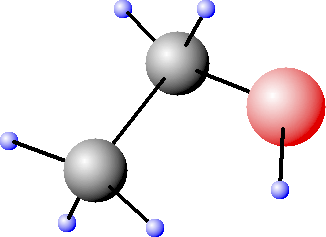
| Jedna z konformacji cząsteczki etanolu. Długości wiązań (pm): C-H 109,36, C-C 152,97, C-O 142,47, O-H 94,51. Kąty między wiązaniami: C-O-H 108o32', H-C-H 109o05' (w CH2) i 108o38' (w CH3), C-C-O 107o20', C-C-H (z CH2) 110o18'. Możliwa jest swobodna rotacja wokół wiązań pojedynczych |
Tabela 1. Własności etanolu i wody
|
Powstała sól (etanolan sodowy) jest w roztworach w etanolu bardzo silną zasadą (mocniejszą niż NaOH) i jest często stosowana w syntezie organicznej.
Halogenki etylowe nie są jednak jonowymi solami, lecz związkami kowalencyjnymi
| [O] | [O] | |||
| C2H5OH | --> | CH3CHO | --> | CH3COOH |
W reakcji z chlorem etanol tworzy aldehyd trójchlorooctowy (chloral)
Działaniem kwasu azotowego i Hg(NO3)2 na etanol otrzymuje się wybuchowy piorunian rtęci Hg(ONC)2.
który w temperaturze 170oC może rozpaść się do etenu (etylenu)
lub w 130oC przereagować z nadmiarem etanolu tworząc eter dwuetylowy
Są to reakcje ważne z punktu widzenia zastosowań przemysłowych.
Reakcja przebiega pod wpływem zymazy. Zymaza to układ kilkunastu enzymów zawartych m.in. w drożdżach. Przebieg procesu jest w rzeczywistości znacznie badziej skomplikowany, biorą w nim udział estry fosforanów glukozy. Zainteresowanych szczegółami można odesłać do podręczników biochemii.
Reakcję można również prowadzić w fazie ciekłej wobec H2SO4 jako katalizatora. W reakcji tej otrzymuje się ubocznie eter dwuetylowy.
Metody chemiczne dają alkohol, który może być stosowany bez specjalnych ograniczeń w przemyśle, natomiast nie nadaje się do celów spożywczych, gdyż zawiera zwykle aldehydy i inne substancje, których oddzielenie jest uciążliwe i nieopłacalne.
|
Interesujące jest, że kilka lat temu produkowano w Polsce wódkę "Vistula" i "Baltic", prawdopodobnie wykorzystując technologię opartą na hydratacji etylenu. Badania specjalistyczne wykazały, że nie nadaje się ona do spożycia ze względu na wysoką zawartość składników toksycznych. Producenci tłumaczyli natomiast, że jest ona dobra, gdyż nawet eksportują ją do Australii.
|
Nie można natomiast stosować bezwodnego CaCl2, gdyż reaguje on z alkoholem podobnie jak z wodą tworząc krystaliczne solwaty:
Sposób fizyczny ma dwa warianty:
Romuald Górski KCh 3/91
