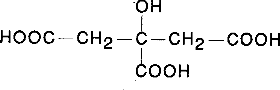
| Stałe dysocjacji kwasów: ortofosforowego i cytrynowego
| Stała | K. fosforowy | K. cytrynowy |
| K1 | 7,6E-3 | 7,4E-4 |
| K2 | 6,3E-8 | 1,7E-5 |
| K3 | 2,5E-13 | 4,0E-7 |
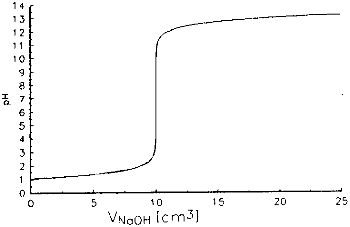
Zarówno H3PO4 jak i kwas cytrynowy są kwasami trójprotonowymi. Ich krzywe miareczkowania wyglądają jednak odmiennie. W przypadku H3PO4 możemy zaobserwować skoki pH odpowiadające zobojętnianiu kolejnych protonów kwasu, natomiast w kwasie cytrynowym widać tylko skok odpowiadający zmiareczkowaniu całego kwasu (pozostałe zlewają się). Różnica w wyglądzie krzywych pochodzi stąd, że kolejne stałe dysocjacjo kwasu fosforowego różnią się od siebie kilkaset tysięcy razy, a kwasu cytrynowego tylko kilkadziesiąt razy
|