

KIBr2 <--> KBr + IBr
3IBr + 4NH3 --> NI3 + 3NH4Br
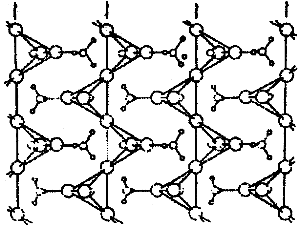 | |
| Rys.2. | Polimeryczna struktura amoniakatu trójjodku azotu NI3*NH3 |
NH3*H2O + I2 --> NH4I + HIO,
który można wykryć dzięki temu, że po dodaniu siarczanu manganu (II) do roztworu wytrąca się brunatny osad. Dalsze dodawanie jodu powoduje wytrącanie się czarnego osadu NH3*NI3. Zatem w drugim etapie tej reakcji musi zachodzić reakcja dysproporcjonowania podjodynu amonowego (jodanu(I) amonu) zgodnie z równaniem:
3NH4IO <--> NH3*NI3 + NH3*H2O + 2H2O
Powyższa reakcja jest odwracalna, gdyż po wprowadzeniu amoniaku do utworzonej z czarnego osadu zawiesiny osad ten rozpuszcza się.
8NI3*NH3 --> 5N2 + 9I2 + 6HN4I
Rozkład, a nawet wybuch, następuje również pod wpływem intensywnego światła w roztworze wodnym lub amoniakalnym. Mogą wówczas mieć miejsce reakcje:
NI3*NH3 --> N2 + 3HI
NI3*NH3 + 5H2O --> 2NH3*H2O + 3HIO
NH3*H2O + HIO --> NH4IO + H2O
3HIO --> 2HI + HIO3
5HI + HIO3 --> 3I2 + 3H2O
NH3*NI3 + 5HI --> 2NH4I + 3I2
Powstawanie kwasu podjodawego HIO jest procesem hydrolitycznym, przebiega zarówno na świetle jak i w ciemności, lecz wytwarzanie azotu N2 i kwasu jodowodorowego HI dokonuje się tylko w obecności światła.
| (*) | Metoda nr 1 otrzymywania NI3*NH3 nie opisana szczegółowo w artykule, który ukazał się w KCh, wydaje się być bardziej wydajna od metody nr 2, stąd zamieszczam poniżej nieco rozszerzony opis metody nr 1. |
Andrzej Kasperowicz
"Połączenia azotu z jodem" stanowią fragment dłuższego artykułu "Halogenopochodne amoniaku" z Kuriera Chemicznego 4/93 (dla ciekawskich: jest tam opisane jeszcze jedno efektowne doświadczenie z wykorzystaniem NCl3 :)).
Praca wpłynęła na Chemfan: 14-05-99
