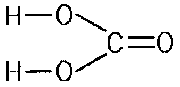
W celu rozwikłania zagadki zastosowano różne chwyty, specyficzne dla tej metody spektroskopii. Napromienoiwywano m.in. mieszaninę "ciężkiego" (deuterowanego) lodu z suchym lodem (D2O i CO2) oraz zwykły lód z "cięż~kim" suchym lod (stałe H2O i 13CO2). Stwierdzono, że obserwowane jest najprawdopodobniej widmo cząsteczek H2CO3, powiązanych ze sobą wiązaniami wodorowymi. Natomiast, badając zmiany widm w trakcie ogrzewania, wykazano, że w temperaturze - 20oC możn przez kilkadziesiąt minut utrzymać warstwy składające się prawdopodobnie z zestalonego kwasu węglowego. Recenzent szanowanego pisma spektroskopistów Spectrochimica Acta nadal powątpiewał, sugerując, że może badacze obserwują mieszaninę ozonu i wody utlenionej autorzy jednak dzielnie odparli ataki niedowiarka. I ja im wierzę.
Jan Cz. Dobrowolski (Instytut Chemii Przemysłowej, Warszawa)
Literatura: M.H.Moore, R.K.Kahanna, Spectrochimica Acta, 1991, 47A, str. 255-262)
KCh 3/91