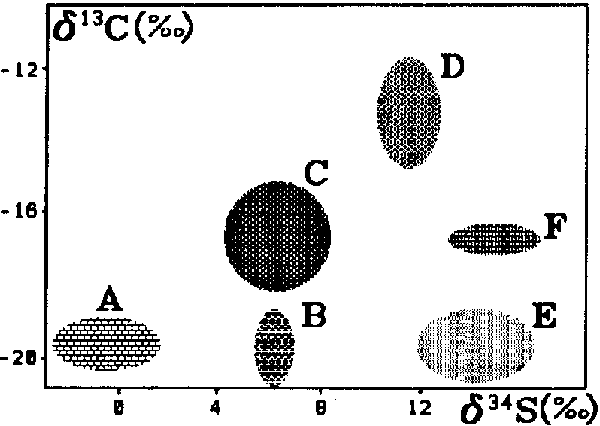
Jak widać, najwięcej izotopu 34S mają mieszkańcy Australii, najwięcej 13C mieszkańcy Brazylii, a najmniej 13C - mieszkańcy Ameryki Północnej. Rozrzut tych wartości związany jest z zawartością izotopów 13C i 34S występujących w pokarmach roślinnych spożywanych w danych krajach. W Ameryce Północnej przeważają rośliny uprawne ubogie w 13C (pszenica, buraki cukrowe oraz inne owoce i warzywa), natomiast w Brazylii dominuje uprawa kukurydzy i trzciny cukrowej, bogatszych w 13C. Znaczne różnice mogą też występować w składzie izotopowym węgla i siarki mieszkańców tego samego kraju (Brisbane i Canberra w Australii), co również można wytłumaczyć zróżnicowaniem składu izotopowego spożywanych przez nich pokarmów. Oprócz wspomnianych już pierwiastków także wiele innych posiada trwałe izotopy. Badanie ich składu w zależności od różnych czynników dostarcza wciąż nowych informacji o organizmach roślinnych zwierzęcych i o samym człowieku.
Piotr Ostręga
Literatura: Priroda, 12/1990
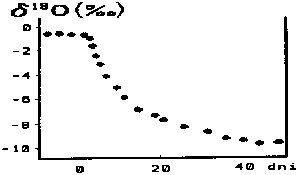
Bruno D. Marino i Michael B. McElroy (Nature, 1990-01-10) podsumowują badania zmian składu izotopowego atmosferycznego CO2. Jak wiadomo, od dawna notuje się systematyczny wzrost stężenia dwutlenku węgla w atmosferze. Dwieście lat temu dwutlenek węgla stanowił 270ppm (0,027%), natomiast w latach 1956- 1989 stężenie to wzrosło z 314ppm do 350ppm. Okazuje się, że temu wzrostowi towarzyszy dostrzegalne zmniejszanie się udziału izotopu 13C. Wartość wskaźnika delta13C dla atmosfery obniżyła się we wspomnianym okresie od -6,7%o do -7,8%o.
Pryczyna tych zmian jest znana. Paliwa kopalne i większość roślin spalanych jako biomasa cechuje obniżona zawartość izotopu 13C, gdyż izotop ten jest minimalnie gorzej przyswajany przez rśliny niż lżejszy 12C. Spalanie węgla kamiennego itp. zmienia więc proporcje izotopów w atmosferze na rzecz 12C.
Wspomniani badacze stwierdzili jednak, że nasiona kukurydzy zachowują bardzo dobrze skład izotopowy węgla atmosferycznego. Ponieważ próbki nasion kukurydzy liczące nawet kilkaset lat są dostępne do badań, będzie można odtworzyć skład izotopowy CO2 w atmosferze Ziemi w poprzednich stuleciach tą ciekawą metodą.
Badanie składu izotopowego siarki (34S) w pyłach zanieczyszczających kanadyjską Arktykę pozwoliły stwierdzić, że zanieczyszczenia te w ok. 80% pochodzą z Europy (prawdopodobnie Wschodniej)...
KCh 2/91