

O pestycydach słów kilkaOkreślenie pestycyd pochodzi od łacińskich słów: pestis = morowe powietrze oraz caedo = niszczę, zabijam (ang. pest = plaga, szkodnik). Służą więc do „zwalczania plag” nawiedzających pola uprawne oraz zwierzęta hodowlane (i człowieka). W ten sposób można dosłownie przetłumaczyć słowo „pestycyd”. Tymi plagami są organizmy szkodliwe z gospodarczego (i zdrowotnego) punktu widzenia, bowiem ekolog powie, że żaden organizm nie jest szkodliwy w przyrodzie. Każdy jest potrzebny, nawet ten wyrządzający znaczne szkody ekonomiczne. Celem stosowania pestycydów jest więc ograniczanie strat w plonie roślin uprawnych (w tym także lasów), poprawienie jego jakości oraz zahamowanie rozprzestrzeniania się chorób ludzi i zwierząt, a nie całkowite zniszczenie określonego gatunku. Straty te powodowane są zarówno poprzez żerowanie na roślinach zwierząt (fitofagów), rozwój mikroorganizmów chorobotwórczych dla roślin jak i konkurencyjne sąsiedztwo roślin dzikich (chwastów). Zwalczanie ich (w szerokim rozumieniu) jest celem dziedziny nauki i techniki zwanej ochroną roślin. Natomiast zwalczaniem zwierząt (głównie owadów i gryzoni), które są wektorami („roznosicielami”) czynników chorobotwórczych dla ludzi i zwierząt hodowlanych (np. szczury, komary malaryczne, muchy) bądź też są uciążliwe dla człowieka i zwierząt (np. komar widliszek nie przenoszący chorób), zajmuje się higiena sanitarna i weterynaryjna. Największe ilości pestycydów stosuje się jednak w ochronie roślin i wtedy nazywa się je środkami ochrony roślin. Nie są to synonimy, ponieważ nie wszystkie pestycydy są środkami ochrony roślin i odwrotnie. Dla przykładu żywych organizmów wykorzystywanych w ochronie roślin nie zalicza się do pestycydów, a insektycydy stosowane w higienie rzecz jasna nie są środkami ochrony roślin, pomimo że mogą zawierać te same substancje biologicznie czynne. Z reguły jeżeli mówi się o pestycydach, ma się na myśli substancję biologicznie czynną preparatu a nie sam preparat handlowy. Natomiast środki ochrony roślin oprócz substancji biologicznie czynnej zawierają:
Istnieją także pestycydy o szerszym działaniu. Dla przykładu większość bakteriocydów jest jednocześnie fungicydami np. Cu(OH)2, czy też fumiganty (środki do gazowania, odkażania gleby) jak: dazomet lub bromek metylu (bromometan) mają działanie totalne tzn. są aktywne wobec zwierząt, mikroorganizmów oraz roślin. Do chemicznych środków ochrony roślin zalicza się poza tym regulatory wzrostu i rozwoju roślin, które w ścisłym znaczeniu nie są pestycydami, chociaż czasami się je do nich zalicza. Nie powodują one śmierci (caedo) zwalczanego organizmu (pestis), a jedynie w określony sposób regulują procesy biologiczne u roślin np. przyśpieszają dojrzewanie owoców i nasion, „skracają” pędy, usuwają zbędną ilość kwiatów na drzewach owocowych, polepszają zdrowotność roślin itp. Podlegają jednak takim samym procedurom rejestracyjnym, co inne środki ochrony roślin. Pod względem chemicznym pestycydy są niezwykle zróżnicowaną grupą substancji. Przyjęło się je systematyzować w zależności od budowy „dominującego” fragmentu cząsteczki. Jest to dość umowna klasyfikacja i niejednokrotnie różni autorzy ten sam związek chemiczny zaliczają do różnych grup. Pomimo tego typu rozbieżności, dla większości pestycydów uzgodniono jednolitą klasyfikację. Wśród zoocydów wyróżnić można kilkanaście głównych grup chemicznych. Tyleż jest także fungicydów, a najbardziej zróżnicowanymi pestycydami są herbicydy, do których zalicza się już kilkadziesiąt grup chemicznych (polecam przy okazji odwiedzić stronę Komitetu ds. Odporności Roślin na Herbicydy i obejrzeć poster przedstawiający klasyfikację herbicydów). Z pestycydami wiąże się wiele nadziei, ale także niebezpieczeństw. Rzeczą zrozumiałą jest, że jeżeli wprowadzi się do środowiska określoną substancję w celu ograniczenia lub wyeliminowania organizmu szkodliwego, nie obędzie się bez skutków ubocznych. Należy pamiętać, że pestycydy są jedyną – obok broni chemicznej – grupą ksenobiotyków (substancji obcych w środowisku), które celowo wprowadza się do środowiska w określonym celu. Temat pestycydów (szczególnie zagrożeń płynących z ich strony), a także tego, co się robi w celu zminimalizowania efektów ubocznych związanych z ich stosowaniem, jest bardzo obszerny i kontrowersyjny, a zarazem ciekawy. Pozostawiam go na osobny artykuł i dyskusję, oczywiście na liście dyskusyjnej ChemFan. |
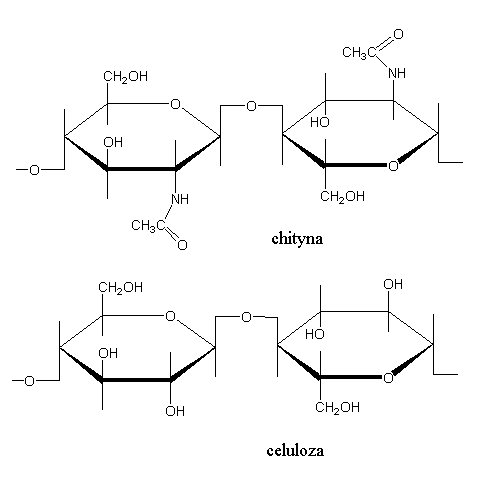
Rys. 1. Porównanie budowy cząsteczek chityny i celulozy – fragmenty struktury. (wg Kączkowskiego 1987)
Biosynteza chityny
We
wstępnym etapie glukoza (Glc) ulega fosforylacji do glukozo-6-fosforanu
[Glc-6-P], a następnie izomeryzacji do fruktozo-6-fosforanu [Fru-6-P]
(przemiany te są powiązane z glikolizą i cyklem pentozofosforanów). Następnie
grupa aminowa –NH2 zostaje przeniesiona z glutaminianu [Glu] na
Fru-6-P (transaminacja), w wyniku czego powstaje glukozamino-6-fosforan
[glukozamino-6-P]. Kolejne etapy polegają na zacetylowaniu grupy aminowej
glukozamino-6-P przy udziale acetylokoenzymu A [acetylo-CoA], izomeryzacji
powstałego N-acetyloglukozamino-6-fosforanu [NAG-6-P] do NAG-1-P i fosforylacji
tego ostatniego przy udziale urydyno-5’-trifosforanu [UTP] do
urydyno-5’-difosforanu-N-acetyloglukozaminy [UDP-NAG], który stanowi dawcę
monomeru łańcucha chityny (rys. 2).
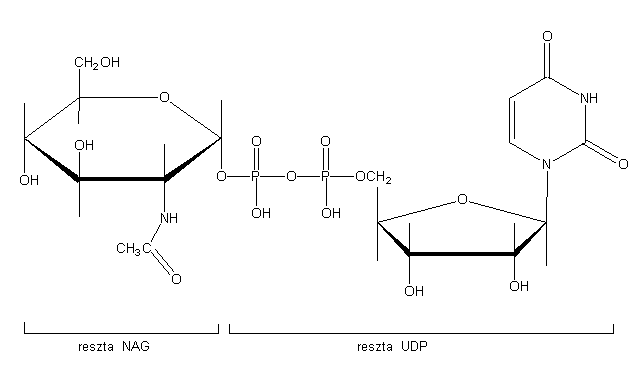
Rys. 2. Prekursor chityny, urydyno-5’-difosforan-N-acetyloglukozaminy UDP-NAG. (wg Corbett’a i in. 1984)
Ostatni etap polega już tylko na polikondensacji UDP-NAG w łańcuch chityny (z wydzieleniem UDP), co katalizuje syntetaza chitynowa (EC 2.4.1.16 chityno-UDP-N-acetyloglukozaminylotransferaza). Jak wynika ze schematu, ostateczny produkt (chityna) powstaje w wyniku kondensacji wysokoenergetycznych cząsteczek UDP-NAG, a nie - jak to by się mogło wydawać - z samych cząsteczek NAG (rys. 3).
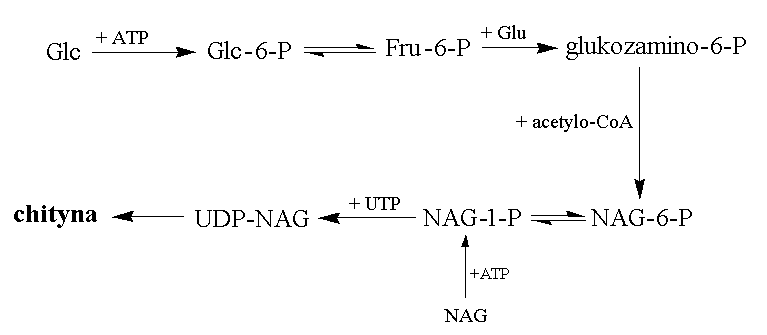
Rys. 3. Uproszczony schemat biosyntezy chityny – wyjaśnienia symboli w tekście powyżej. (oprac. własne wg Corbett’a i wsp. 1984 oraz Kączkowskiego 1987 )
Inhibitory biosyntezy chityny (IBCh)
Jak już
wspomniałem, chityna występuje głównie u grzybów i stawonogów. Znane są także
dwa rodzaje IBCh różniące się organizmami, wobec których są aktywne:
Inhibitory biosyntezy chityny jako fungicydy znane są od lat sześćdziesiatych (1966), kiedy to wykryto w produktach fermentacji promieniowców Streptomyces cacaoi var. asoensis nową grupę antybiotyków: polioksyny (nie mylić z polimyksynami i polinoksyliną stosowanymi w medycynie – są to zupełnie inne związki, tylko nazwy mają bardzo podobne). Szybko się okazało, że wykazują one silne działanie przeciwgrzybowe (fungicydalne). Hamują biosyntezę chityny poprzez kompetycyjną inhibicję syntetazy chitynowej w ostatnim etapie tego szlaku metabolicznego. Oznacza to, że polioksyny „współzawodniczą” z substratem (UDP-NAG) o miejsce w centrum aktywnym enzymu. Związane jest to z podobieństwem budowy polioksyn do prekursora chityny UDP-NAG (porównaj rys. 2 i 4).
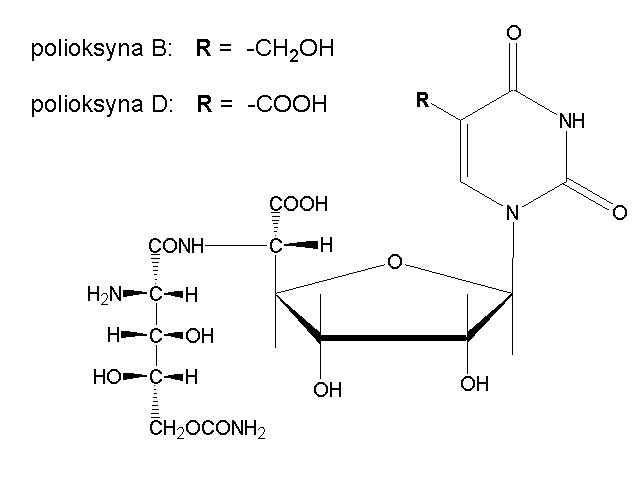
Rys. 4. Antybiotyki z grupy inhibitorów biosyntezy chityny – polioksyna B i D. (wg The Pesticide Manual… 2000)
Potraktowane tymi antybiotykami hodowle niektórych gatunków grzybów w nowo tworzących się komórkach nie wytwarzają ściany komórkowej, dlatego znalazły zastosowanie w otrzymywaniu protoplastów grzybów (wykorzystywanie – jako metoda badawcza w mykologii). Antybiotyki te nie znalazły zastosowania w medycynie, lecz są szeroko stosowane w Japonii w ochronie wielu gatunków roślin jako fungicydy o działaniu systemicznym (czyli migrujących po całej roślinie) dzięki dobrej rozpuszczalności w wodzie. Wykazują szerokie spektrum działania przeciwgrzybowego. Zwalczają tak uciążliwe grzyby jak z rodzaju Botrytis, Alternaria, Rhizoctonia, a są przy tym praktycznie nieszkodliwe dla człowieka i środowiska. Dawka śmiertelna (doustna) LD50 polioksyny B dla szczurów i myszy wynosi aż 21 000 – 27 300 mg/kg masy ciała, a polioksyny D >9 600 mg/kg m.c. Stężenie śmiertelne LC50 dla ryb i dla rozwielitek Daphnia pulex > 40 mg/l (oba związki). Są to wartości bardzo duże, zbliżone lub większe niż prostych związków organicznych, które „spożywamy” na co dzień jak: kwas octowy (LD50=3 300 mg/kg m.c.), kwas cytrynowy (LD50=3 000 mg/kg m.c.), chlorek sodu (LD50 = 3 000 mg/kg m.c.), czy też sacharoza (LD50=29 700 mg/kg m.c.). W związku z tym zalicza się je do najmniej toksycznych fungicydów. Pewnym ograniczeniem ich przydatności jest mała trwałość w roztworach wodnych - okres półtrwania polioksyny D w roztworze o pH=5,5 (24 ºC) wynosi zaledwie 4 godziny(!). Prawdopodobnie ze względu na małą trwałość nie znalazły zastosowania w medycynie. W Polsce nie są zarejestrowane jako środki ochrony roślin. A szkoda.
Inhibitory biosyntezy chityny jako zoocydy całkiem przypadkowo odkryto w latach siedemdziesiątych (1972r.) w laboratoriach firmy Philips-Duphar B.V. Prowadzono wtedy badania nad pochodnymi herbicydów (środków chwastobójczych): dichlobenilu i fenuronu (rys. 5).
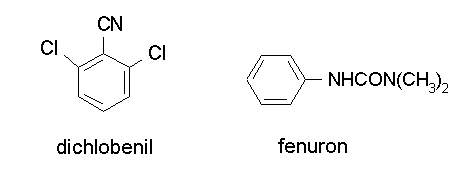
Rys. 5. Dichlobenil i fenuron – herbicydy, od których wszystko się zaczęło. (wg The Pesticide Manual… 2000)
Stwierdzono, że ich pochodne benzylomocznikowe (rys. 6) powodują śmierć testowanych larw owadów po kilku dniach od zastosowania, a zupełnie nie działają na osobniki dorosłe. Był to efekt zupełnie nowy, wcześniej nie obserwowany wśród znanych wówczas insektycydów. Wszystkie dotychczasowe środki owadobójcze (neurotoksyny) działały bardzo szybko i to niezależnie czy to była larwa czy osobnik dorosły (imago). A tu coś nowego! Pojawiła się nowa szansa dla chemicznej ochrony roślin, tak w tych czasach krytykowanej. Właściwość ta (nieaktywność wobec imago) okazała się bardzo pozytywną cechą, ponieważ liczne szkodniki roślin największą żarłoczność wykazują w stadium larwalnym. Niektóre z nich (np. motyle Lepidoptera) są szkodnikami tylko w tym stadium. Poza tym pochodne benzylomocznikowe charakteryzują się słabą przenikalnością przez oskórek, przez co działają niemal wyłącznie żołądkowo. Oznacza to, że larwa zatruwa się tylko po spożyciu potraktowanej rośliny. Cechy te sprawiły, że zoocydy te są stosunkowo bezpieczne dla stawonogów nieroślinożernych, czyli pożytecznych (drapieżców, parazytoidów, zapylaczy i innych). Dodatkową cechą użytkową tych związków jest działanie jajobójcze (owitoksyczne, owicydalne). Niestety ma to swoje plusy i minusy. Oprócz jaj owadów i roztoczy szkodliwych mogą zniszczyć jaja stawonogów pożytecznych. Poza tym mogą w pewnych ilościach dostawać się do organizmu samicy i zmniejszyć przeżywalność zarodków w jajach przez nią później złożonych; dlatego użyłem frazy „stosunkowo bezpieczne”. Pomimo tych niewielkich skutków ubocznych, są to jedne z najbezpieczniejszych zoocydów jakie dotychczas wynaleziono. Są przeważnie mało toksyczne dla ssaków, ptaków, ryb, dżdżownic i glonów. Mankamentem ich jest wysoka toksyczność dla skorupiaków. Stężenie śmiertelne dla rozwielitek Daphnia sp. LC50(EC50) mieści się w granicach 0,1-200 μg/l. Zgodnie z polskimi przepisami środki ochrony roślin, których ten wskaźnik wynosi <1000 μg/l zalicza się do „środków toksycznych dla rozwielitek klasy I”. Dlatego należy się wystrzegać stosowania tych zoocydów w pobliżu zbiorników wodnych lub też w samych zbiorkach (np. do zwalczania larw komarów). Dotyczy to również innych pestycydów, ponieważ niewiele jest takich, które są mało szkodliwe dla organizmów wodnych. Wysoka toksyczność IBCh dla skorupiaków związana jest z przynależnością taksonomiczną, a przez to podobieństwem szlaku biosyntezy chityny do tego, jaki występuje u owadów. Jak wiemy, zarówno owady jak i skorupiaki należą do typu stawonogów.
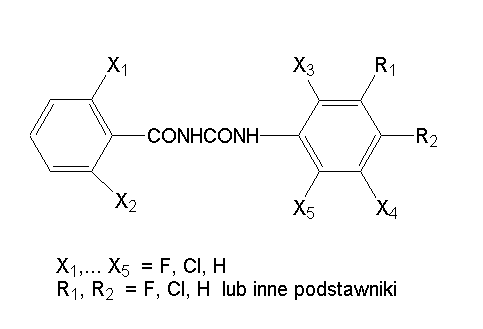
Rys. 6. Wzór ogólny zoocydów benzylomocznikowych (opracowanie własne na podstawie struktur znanych obecnie związków z tej grupy)
O ile w
przypadku polioksyn hamowanie biosyntezy chityny wiązało się z inhibicją
syntetazy chitynowej, o tyle w odniesieniu do zoocydów benzylomocznikowych
mechanizm jest znacznie bardziej złożony i nie do końca wyjaśniony. Nie
działają one hamująco na komórki grzybów. Przypuszcza się, że główną rolę
odgrywają w metabolizmie hormonu wylinkowego ekdyzonu, który reguluje proces
metamorfozy, w tym także biosyntezę chityny. Wspomniałem, że zoocydy te nie
wpływają na przeżywalność osobników dorosłych. Dlaczego? Otóż, wiąże się to z
biologią stawonogów, które przechodzą kilka stadiów rozwojowych (najczęściej:
jajo, larwa, poczwarka, imago). U owadów (i innych stawonogów) szkielet
zewnętrzny (kutikula) jest tworem martwym, więc nie ma zdolności rozrastania
się. Aby organizm mógł rosnąć musi zrzucić stary, „za ciasny” oskórek (tzw.
wylinkę) i wytworzyć sobie nowy, którego zasadniczym składnikiem jest chityna.
Owady dorosłe nie rosną, więc nie syntetyzują chityny i dlatego IBCh nie
działają na nie.
Tak na
marginesie. Herbicyd dichlobenil, od którego wszystko się zaczęło, jest
inhibitorem biosyntezy celulozy u roślin. Czy ma to jakiś związek z inhibicją
biosyntezy chityny zoocydów benzylomocznikowych? To pytanie pozostawiam bez jednoznacznej
odpowiedzi. Wydaje się, że jest to raczej przypadkowe podobieństwo.
Pierwszym
insektycydem z grupy pochodnych benzylomocznika (zwanych czasami
acylomocznikowymi) był diflubenzuron (rys. 7), wprowadzony na rynek w
1975 r. przez firmę Philips Duphar B.V. (obecnie Uniroyal Chemical, USA) w
preparacie pod nazwą Dimilin. Preparat ten jest do dziś stosowany na całym
świecie, w tym także w Polsce. Podobnie jak inne z tej grupy, jest zalecany
szczególnie w integrowanych programach ochrony roślin i do zwalczania
szkodników leśnych. W niektórych krajach stosuje się diflubenzuron w higienie
sanitarnej i weterynaryjnej (zwalczanie larw much, pcheł i komarów). Zwalczanie
larw komarów w zbiornikach wodnych budzi pewien niepokój, ponieważ może to
spowodować zniszczenie zooplanktonu w większości wrażliwego na te zoocydy.
W chwili obecnej znanych jest dziesięć pochodnych benzylomocznikowych, a
lista z pewnością nie jest zamknięta (rys. 7). Wszystkie są substancjami stałymi
(temperatura topnienia >200 ºC) o bardzo małej prężności par, trudno
rozpuszczalnymi w wodzie (<0,08 mg/l), a dobrze – w rozpuszczalnikach
organicznych. W 1984 r. wprowadzono do obrotu i stosowania drugi insektycyd z
tej grupy teflubenzuron. Znalazł zastosowanie w ochronie roślin oraz w
akcjach zwalczania komarów. Używany jest także przeciwko larwom much i
pasożytów łososia (co jest pewnym nowum). W Polsce stosowany jest od 1992 r.
pod nazwą Nomolt. Heksaflumuron stosowany w ochronie roślin od 1987 r.,
a do zwalczania termitów od 1995 r. Wymienione insektycydy działają skutecznie
wyłącznie na owady. Do pochodnych benzylomocznika aktywnych zarówno wobec larw
(i jaj) owadów jak i roztoczy należą: flufenoksuron, flucykloksuron i
lufenuron. Odgrywają one istotną rolę w zwalczaniu roślinożernych roztoczy,
zwłaszcza w sadach i w uprawach pod osłonami, gdzie bardzo ważne jest
stosowanie selektywnych środków, nie szkodliwych dla roztoczy drapieżnych (pożytecznych).
Są także znaczącym elementem ograniczania powstawania odporności roztoczy na
akarycydy. Dotyczy to również owadów i to nie tylko w tych uprawach. Lufenuron
jest stosowany poza tym przeciwko pasożytom zewnętrznym naszych domowych
pupilków. Najnowszym insektycydem z tej grupy jest novaluron,
zastosowany po raz pierwszy w 1996 r. W Polsce zarejestrowany w 2000 r.
Wszystkie siedem wymienionych zoocydów (inektycydów i inektycydo-akarycydów)
dopuszczone są do obrotu i stosowania w Polsce (w ochronie roślin). Poza nimi
znane są jeszcze chlorfluazuron (zastosowanie: ochrona roślin), triflumuron
(ochrona roślin i higiena – pchły, wszy, karaczany) i fluazuron
(zwalczanie pasożyta bydła Boophilus microplus).
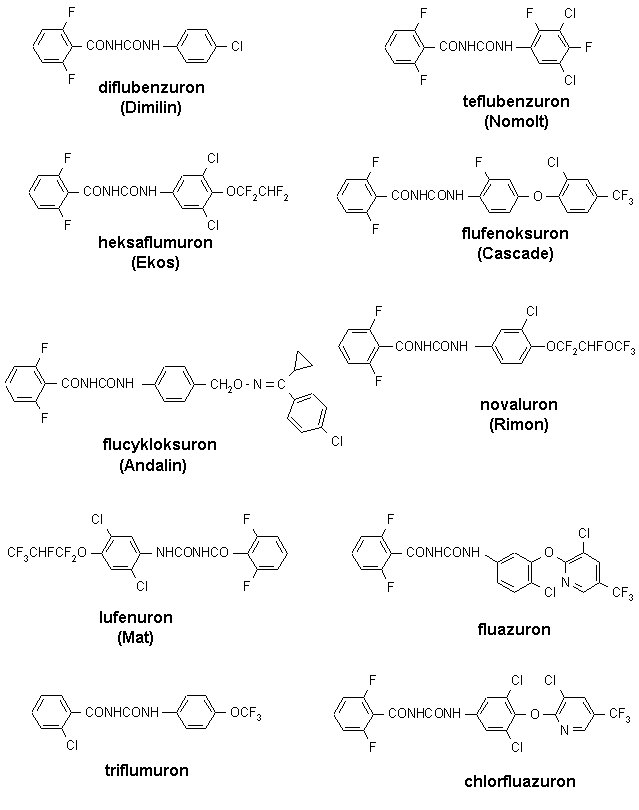
Rys. 7. Zoocydy benzylomocznikowe – w nawiasie podano nazwy handlowe zarejestrowanych w Polsce preparatów (wg The Pesticide Manual... 2000 oraz Zaleceń ochrony... 2002)
Oprócz zoocydów benzylomocznikowych znane są jeszcze inne, które hamują biosyntezę chityny, a przez to przeobrażenia owadów i roztoczy. Należą do nich: buprofezyna i cyromazyna (rys. 8). Pierwsza z nich wykazuje działanie owadobójcze i roztoczobójcze i to zarówno po ekspozycji żołądkowej jak i kontaktowej. Jest prawdopodobnie inhibitorem biosyntezy chityny i prostaglandyn. Druga substancja działa także żołądkowo i kontaktowo na larwy owadów (głównie muchówek Diptera). W przeciwieństwie do zoocydów benzylomocznikowych, cyromazyna ma działanie systemiczne, tzn. po zastosowaniu na fragment rośliny przemieszcza się do innej części np. po podlaniu roztworem, z korzeni ulega dystrybucji do liści. Ma ograniczone zastosowanie (ochrona roślin ozdobnych i pieczarek). Obie substancje są mało szkodliwe dla ssaków, ptaków, ryb, pszczół, glonów i dżdżownic. Są także mało toksyczne dla skorupiaków, co odróżnia je od pochodnych benzylomocznika.
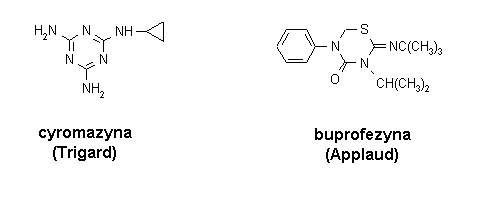
Rys. 8. Buprofezyna i cyromazyna – przedstawiciele IBCh z innych grup chemicznych (wg Goszczyńskiego 1993)
Podsumowanie
Zoocydy
z grupy inhibitorów biosyntezy chityny spełniają szereg wymagań stawianych nowoczesnym
preparatom przeznaczonym do ochrony roślin oraz zdrowia ludzi i zwierząt.
Charakteryzują się niską toksycznością dla kręgowców, dżdżownic, glonów wodnych
i większości entomofauny pożytecznej. Przy tym posiadają krótki okres zalegania
w glebie, wysoką aktywność przeciwko larwom szkodliwych stawonogów (w niskich
dawkach) oraz długi okres działania na opryskanych roślinach. Działają
wyłącznie na młodociane stadia rozwojowe, nie wpływając na osobniki dorosłe.
Powyższe właściwości powodują, że IBCh odznaczają się wysoką selektywnością, działając
toksycznie głównie na roślinożerne owady i roztocza. Stanowią istotny element
integrowanych programów ochrony roślin rolniczych i ogrodniczych i są wręcz
niezbędne w ochronie drzewostanów. W tym ostatnim przypadku niemal całkowicie
wyparły nieselektywne insektycydy fosforoorganiczne i pyretroidy (syntetyczne pochodne naturalnych pyretryn występujących w
niektórych gatunkach roślin z rodzaju Chrysanthemum, będących estrami kwasu
chryzantemowego, czyli kwasu 2,2-dimetylo-3-(2-metylo-1-propenylo)-cyklopropanokarboksylowego). Obecnie do
ochrony lasów, borów i puszcz zaleca się w pierwszym rzędzie stosowanie
biopreparatów opartych na bakterii Bacillus thuringiensis i inektycydów
benzylomocznikowych. Pomimo tych niewątpliwych zalet, nie zastąpią one
całkowicie zoocydów II-generacji z dwóch zasadniczych powodów:
Inhibitory biosyntezy chityny powinny być jednak stosowane wszędzie tam, gdzie jest możliwe zastąpienie nimi innych, mniej selektywnych i (lub) bardziej toksycznych zoocydów. Są doskonałym przykładem rozwoju wiedzy i postępu technicznego w przemyśle fitofarmaceutycznym w kierunku zachowywania równowagi biologicznej w biocenozach.
Na zakończenie mała uwaga dotycząca nazewnictwa. W artykule niniejszym trzymałem się bezwzględnie określenia „biosynteza chityny”, ponieważ słowo „synteza” może na pierwszy „rzut oka” sugerować czysto chemiczną syntezę, a przecież nie o to tu chodzi. Pomimo tego często w literaturze polskiej spotyka się określenie „inhibitory syntezy chityny”. Która forma jest bardziej poprawna? Jest to sprawą dyskusyjną. W każdym bądź razie biochemicy raczej używają słowa „biosynteza”.
Kazimierz Warmiński
Uniwersytet
Warmińsko-Mazurski w Olsztynie
Wydział Kształtowania
Środowiska i Rolnictwa
Katedra Ochrony Powietrza i
Toksykologii Środowiska
pl. Łódzki 2, 10-723 Olsztyn
tel. (0-89) 523 35 60, tel./fax. 523 45 94
kazet@uwm.edu.pl
Literatura
Wybrane akty prawne
Polecam także artykuły:
– : kazimierz.warminski@uwm.edu.pl
lub porozmawiajmy na
liście dyskusyjnej ChemFan.
Praca wpłynęła do Chemfana: 12-09-2002
